Патогенез
Как упоминалось выше этиология (причина) РА к настоящему времени остается неизвестной, несмотря на колоссальные усилия исследователей и невероятное количество накопленных к настоящему времени научных фактов и свидетельств. Однако большинство исследователей убеждены, что подобно другим аутоиммунным заболеваниям причиной РА следует считать сочетание как минимум двух компонентов, а именно генетических факторов и инфекционного патогена, эффекты которых взаимопотенцируются в условиях экспозиции индивидуума «подходящими» факторами окружающей среды, прежде всего на фоне хронического курения (Firestein G.S., 2008).
Достигнут существенный прогресс в понимании механизмов патогенеза и уже не вызывает сомнения тот факт, в основе патогенеза и клинических проявлений РА лежат реакции, имеющие сугубо иммунологическую природу. Благодаря широкому арсеналу методов молекулярной биологии довольно подробно описаны биологические эффекты различных низкомолекулярных медиаторов воспаления, в частности метаболитов арахидоновой кислоты, а также аутоантител, цитокинов, факторов роста, хемокинов, молекул адгезии, матриксных металлопротеиназ, и оценен их потенциальный вклад в механизм развития и прогрессирования РА.
Каждая из этих перечисленных молекул рассматривается в качестве потенциальной мишени для фармакотерапевтических интервенций (Firestein G.S., 2008). В случае РА индукция иммунологических реакций, приводящих, в конечном итоге, к заболеванию, носят более или менее тканеспецифичный характер и локализованы, прежде всего, в тканях периферических суставов.
Согласно данным литературы, вероятно, процесс развития РА может быть условно разделен на следующие этапы (Ankur Shah, 2012):
- Фаза инициирования (индукции)
- Фаза амплификации
- Фаза хронического воспаления с сопутствующих тканевым повреждением.
Считается, что на фазе инициирования (индукции) под воздействием тех или иных этиологических факторов происходит активация механизмов неспецифического локального внутреннего иммунитета, который как бы «подготавливает» сустав к последующему более агрессивному деструктивному воспалению с участием иммунных клеток. Сигаретный дым, продукты бактериального происхождения, структурные компоненты вирусов и иные экзогенные факторы могут потенциально выступать в качестве индукторов таких ответов. В норме подобные реакции со стороны иммунитета протекают постоянно, однако у здоровых индивидуумов они лимитируются специфическими транскрипционными факторами, называемыми аутоиммунными регуляторами (AIRE15). Эти факторы продуцируются в медулле вилочковой железы (тимуса) и контролируют механизмы подавления иммунных ответов, направленных против собственных тканей организма.
Итак, экзогенные факторы индуцируют реакции внутреннего (неспецифического) иммунитета с участием, в первые очередь, молекул белков главного комплекса гистосовместимости (МНС), локализованных на поверхности клеток суставов. Эти молекулы выступают в роли «распознавателей» чужеродных агентов, заведомо обладающих патогенным (болезнетворным) потенциалом. Патогены, называемые в иммунологии «антигенами», присоединяются к Fc-региону молекул-распознователей (МНС) на мембранах фибробласт-подобных синовиоцитов (FLC)16, дендритных клеток (DC) и макрофагов (МФ), что фактически и определяет их критически важное значение в промотировании ответов на ранних этапах РА.
Все перечисленные типы клеток, а именно синовиоциты, макрофаги, дендритные клетки, за счет МНС молекулы класса II способны реализовывать функции так называемых антигенпрезентирующих клеток. Поглощение антигена этими клетками и его последующий его процессинг, проще говоря, частичное «переваривание» с участием лизосомальных ферментов, приводит к высвобождению из его первичной структуры эпитопов – фрагментов, ответственных за взаимодействие с факторами специфического иммунного ответа. Транспортирование этих эпитопов из цитоплазмы клеток к поверхности мембраны и его дальнейшее фиксирование предопределяет в последующем роль антигенпрезентирующих клеток в качестве «центра» специфических иммунных реакций с участием активированных цитотоксических Т-лимфоцитов (CTL) популяций CD4+ и CD8+.
Макрофаги (М). Макрофаги обладают огромным провоспалительным, деструктивным и ремоделирующим потенциалом и играют интегральную роль в развитии воспаления и деструкции суставов. На ранних этапах развития РА происходит кумулирование активированных макрофагов и других моноядерных лейкоцитов в синовиальной оболочке, суставном хряще, а также экстрасуставном компартменте суставов (сосуды, субэндотелиальное пространство). Активированные антигеном макрофаги параллельно с этим продуцируют цитокины, в том числе TNF-a, IL-b? и IL-6, обладающие пролиферативным, провоспалительным действием, а также индуцирующие другие звенья иммунитета (Рисунок 4 и Таблица 15).
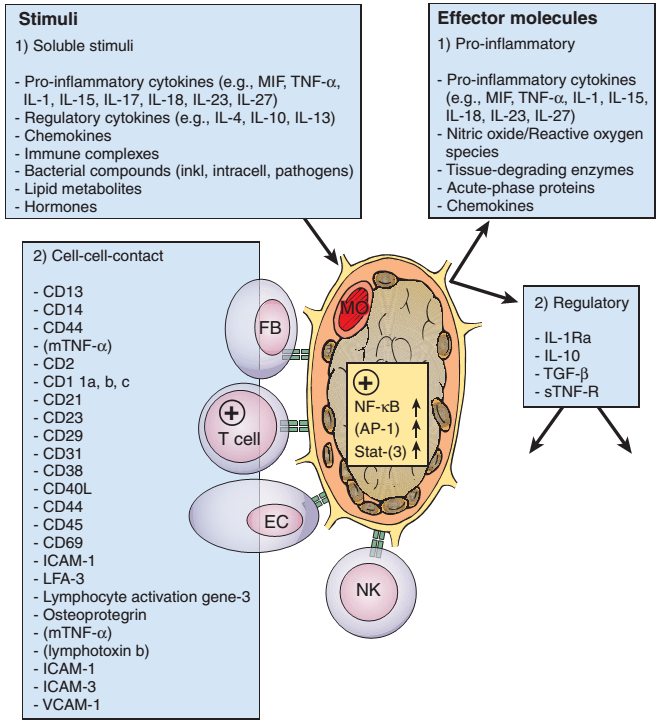
Рисунок 4. Паракринные, юкстакринные и аутокринные стимулы и эффекторные молекулы, запускающие активацию макрофагов на фоне ревматоидного артрита (Hochberg M.C., Rheumatoid arthritis, 2009)
Таблица 15 . Основные провоспалительные эффекторные молекулы продуцируемые активированными макрофагами при ревматоидном артрите запускающие активацию макрофагов на фоне ревматоидного артрита (Hochberg M.C., Rheumatoid arthritis, 2009)
| Цитокин |
Эффекты |
|
TNF-a |
Оказывает плейотропные эффекты: стимулирует экспрессию других провоспалительных цитокинов, молекул адгезии, PgE2, коллагеназы, а также коллагена синовиальными клетками При РА в комбинации с IL-1 индуцирует развитие синовита, хронизации артрита, а поскольку продуцируется также в экстрасуставных тканях (лимфоидных органах) может быть ответственным за развитие системных проявлений РА |
|
IL-1 |
Уровень IL-1 в синовиальной жидкости коррелирует с интенсивностью воспалительного процесса в суставе. Ответственен за подавляющее большинство суставных повреждений, в частности за счет подавления синтеза протеогликана и активации его деградации. Стимулирует повышение активности ММР-1 и ММР-3 и потенцирует процессы резорбции костной ткани |
|
Хемокины |
Стимулируют продукцию TNF-a макрофагами и IL-1 Индуцируют ангиогенез |
|
Фактор ингибирования миграции макрофагов (MIF) |
По аутокринному типу индуцирует большинство функций макрофагов, в том числе фагоцитоз, продукцию TNF-a и свободнорадикальных форм кислорода, а также повышает резистентность макрофагов и синовиоцитов к апоптозу |
Дендритные клетки распространены в организме человека практически повсеместно. Образуясь в процессе гематопоэза в красном костном мозге из прекурсоров, мигрирующих в периферические ткани, дендритные клетки мигрируют в периферические ткани, где выполняют функции преференциальных антигенпрезентирующих клеток, то есть специализируются на распознавании, процессинге и презентации антигенов для цитотоксических Т-клеток и В-клеток, продуцирующих антитела против антигенов (в том числе(RF-фактор и АЦЦП).
После поглощения растворимых антигенов дендритные клетки быстро пересекают эндотелий лимфатических сосудов и мигрируют в направлении лимфоидных органов. Одновременно с процессом миграции дендритные клетки «созревают», то есть в них запускается процессинг антигена, стимулируется синтез ко-стимулирующих молекул, изменяется их морфология. Все это способствует, в конечном итоге, презентации эпитопов антигена на поверхности их мембраны. К моменту поступления в лимфоузлы процесс созревания заканчивается и далее дендритные клетки приобретают свойстваантигенпрезентирующих клеток, которые индуцируют прайминг наивных Т-клеток, то есть из наивных Т-лимфоцитов образуются антигенспецифические Т-клетки.
Процесс созревания дендритных клеток регулируется широким набором факторов, в т.ч. патоген-продуцируемыми молекулами (липополисахариды клеточной стенки бактерий, ДНК, РНК), а также провоспалительными цитокинами (TNF, IL-1, IL-6), в частности продуцируемых макрофагами, а также тканевыми фрагментами (гиалуронан), сигналами от активированных Т-клеток.
Вероятно, макрофаги и дендритные клетки являются принципиальными звеньями спонтанной инициации аутоиммунных реакций при РА.
Провоспалительные цитокины, продуцируемые макрофагами, а также активированными синовиоцитами, становятся основным стимулом агрессивной пролиферации (деления) синовиальных клеток, а значит и разрастания синовиальной оболочки. Гиперпродукция провоспалительных цитокинов лежит в основе повреждения синовиальной оболочки сустава, хряща (а впоследствии и кости), а также в основе развития системных проявлений РА.
Имеется предположение, что TNF-a и IL-17 и другие провоспалительные цитокины становятся основными факторами трансформации острого иммунного воспаления (свойственного ранней стадии РА) в хроническое с развитием паннуса и необратимым разрушением суставных структур. Одним из необходимых условий опухолеподобного роста паннуса и его инвазии в хрящевую и костную ткань при РА считается неоангиогенез, т.е. развитие в его ткани новых кровеносных сосудов. Васкулярная пролиферация при РА обнаруживается только в тканях воспаленных суставов.
На фоне РА наблюдается локальная гипоксия и гипоперфузия синовиальной оболочки, что приводит к увеличению синовиальной инфильтрации и гиперплазии, синтезу цитокинов и факторов роста, в частности сосудистого эндотелиального фактора роста (VEGF). При участии VEGF продуцируемые растущим паннусом протеолитические матриксные металлопротеиназы (ММП), главным образом ММП-9 (желатиназа В), в дальнейшем приводят к ревматоидной костно-хрящевой деструкции (Hochberg M.C., Rheumatoid arthritis, 2009)(Firestein G.S., 2008) (Черненков Ю.В., 2013).
‹‹ Предыдущая Следующая ››
Автор материала: Булгакова Яна Сергеевна, кандидат биологических наук, ООО Сайнсфайлз
Понравилась статья? Поделись с друзьями!
Также стоит почитать:
Загрузка...



























 Важно знать:
Важно знать: Полезно:
Полезно: Интересно:
Интересно:




