Энтеропатические артриты
Энтеропатические артропатии, или артриты, представляют собой группу гетерогенных артропатий, развитие которых напрямую ассоциируется с персистирующей патологией (воспалением) кишечника (как правило, толстой кишки)(Firestein G.S., 2008).
К энтеропатических артритам относятся:
- Реактивный артрит (в случае кишечных инфекций)
- Спондилоартриты, ассоциированные с воспалением толстой кишки на фоне болезни Крона и неспецифического язвенного колита
- Болезнь Уиппла
- Коллагенозный колит
- Артрит на фоне глютеновой энтеропатии.
Схематически патогенез развития энтеропатических артритом представлен на Рисунке 35 далее ниже.
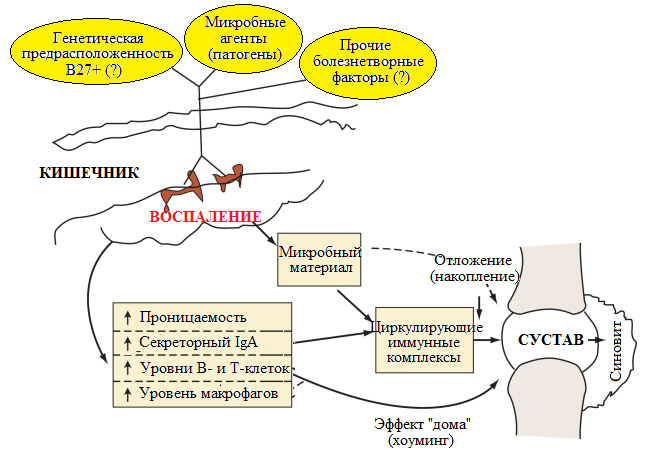
Рисунок 35. Основные звенья патогенеза энтеропатических артритов (адаптировано из (Firestein G.S., 2008))
Лимфоидные ткани, локализованные в кишечнике (GALT71), представляют собой крупнейший лимфоидный орган в организме человека, включающий примерно 25% всей представленной в организме массы слизистых. Основные компоненты GALT представлены Пейеровыми бляшками, лимфоидными фолликулами кишечника, собственной пластинкой слизистой оболочки (lamina propria), а также интраэпителиальными Т-клетками. В Пейеровых бляшках дистального сегмента подвздошной кишки продуцируется эпителиальный протеин, называемый секреторным компонентом, или полимерным (трансмембранным) рецептором к иммуноглобулину. Этот протеин содержит цепь J, присущую IgA и IgM. Секреторный коспонент формирует комплексы с секреторными IgA и IgM, секретируемыми в просвет кишечника, которые фактически создают основу для первичного невоспалительного защитного ответа организма на попадающие с пищей антигены (без вовлечения комплемента).
Образование комплексов иммуноглобулинов с секреторным компонентов запускает процесс прайминга (дифференцировки) В-лимфоцитов, которые диссеминируют из Пейеровых бляшек в слизистые оболочки организма, но прежде всего в другие отделы ЖКТ. Примированные Т-лимфоциты мигрируют в циркуляторное русло и лимфатические узлы, а также в другие ткани-мишени, в частности в слюнные железы (при болезни Шегрена), легкие и синовиальные оболочки (хоуминг), что обусловлено наличием на поверхности мембран клеток в этих тканей особого «привлекающего» их фактора, представленного протеином сосудистой адгезии VAP-172.
Кроме того, продуцируемый, в частности синовиальными клетками белок Р-селектин индуцирует активацию и дифференциацию макрофагов. VAP-1 – бифункциональный протеин, обладающие как адгезивными, так и оксидативными свойствами. Ингибирование этой молекулы может являться потенциальной мишенью для таргетной терапии энтеропатических артритов. Большинство Т-лимфоцитов, локализованных в слизистой оболочке кишечника (lamina propria) относятся к популяции клеток CD4+, в то время как интраэпителиальные Т-клетки в большинстве своем представляют собой цитотоксические Т-клетки популяции CD8+. Таким образом, эти клетки активируются при стимуляции интестинальных дендритных клеток.
Патогенез энтеропатических артритов с участием выше перечисленных компонентов, вероятно, может запускаться в случаях желудочно-кишечных инфекций, вызываемых соответствующими микроорганизмами, а также возможно при наличии генетической предрасположенности. Сочетание этих факторов индуцирует локальное воспаление в слизистой кишечника, продукцию секреторного IgA, увеличение проницаемости слизистой, абсорбцию патогенного материала и активацию Т-лимфоцитов. Образуемые в результате циркулирующие иммунные комплексы и Т-клетки кумулируют в тканях суставов и индуцируют развитие синовита (Firestein G.S., 2008).
В настоящее время в распоряжении врача имеется достаточно большой арсенал лекарственных средств, эффективных в лечении больных с хроническими воспалительными заболеваниями кишечника.
Выбор лекарственных средств и метода лечения зависит от следующих характеристик заболевания у конкретного больного:
- распространенность (локализация) патологического процесса в кишечнике.
- степень тяжести обострения (легкая, средняя, тяжелая), которая не всегда коррелирует с распространенностью воспалительного процесса. Определение тяжести заболевания необходимо, в первую очередь, для решения вопроса о необходимости госпитализации пациента и назначения гормональной терапии.
- эффективность использованных ранее лекарственных средств (при предыдущем обострении и до начала назначаемой терапии).
- наличие осложнений.
Базисными в лечении НЯК являются две группы препаратов:
- Препараты 5-аминосалициловой кислоты (сульфасалазин, месалазин).
- Глюкокортикостероиды (ГКС).
- Глюкокортикоиды применяют при тяжелом течении НЯК или в случае неэффективности предшествующей терапии препаратами 5-АСК. Внутривенное применение ГКС в течение 5 дней приводит к достижению клинической ремиссии у 55-60% больных с тяжелым обострением язвенного колита. Частота ремиссии возрастает при продолжении в/в терапии ГКС.
Существует мнение о том, что если парентеральное применение ГКС в течение 8-10 дней не приводит к достижению клинической ремиссии, рекомендуется ставить вопрос о целесообразности хирургического лечения.
НПВС широко применяются для купирования болевого синдрома. Метронидазол, ципрофлоксацин и другие плохоабсорбируемые противомикробные средства широкого спектра действия широко используются для терапии пациентов с воспалительными заболеваниями кишечника. В то же время в настоящее время имеются весьма противоречивые данные относительно превосходства их эффективности в сравнении с плацебо. Кроме того, они менее эффективны в сравнении с ГКС (Firestein G.S., 2008).
Иммуносупрессоры (азатиоприн, метотрексат, циклоспорин) при лечении НЯК являются препаратами резерва. Показанием для их назначения являются стероидозависимость и стероидорезистентность. Инфликсимаб (Ремикейд®) — антицитокиновый препарат биологического происхождения, который представляет собой химерные человеческо-мышиные моноклональные антитела (IgG) к провоспалительному цитокину - фактору некроза опухолей альфа (TNF-?). Клиническая эффективность инфликсимаба связана с его противовоспалительным и иммуномодулирующим действием на слизистую оболочку кишечника; при этом, однако, не происходит подавления системного иммунного ответа.
После внутривенного введения инфликсимаб длительное время циркулирует в крови, что позволяет вводить его один раз в 4—8 нед. Известно, что у больных НЯК обнаруживаются повышенные концентрации TNF-? в сыворотке, которые снижаются во время ремиссии заболевания. Показанием для назначения инфликсимаба при НЯК (с 2006 г.) являются среднетяжелые и тяжелые формы заболевания (индекс Мейо - от 6 до 12) при неэффективности, непереносимости стандартной терапии или наличии противопоказаний к ее проведению. Инфликсимаб при НЯК рекомендуется вводить каждые 8 нед после индукционной терапии (индукционная схема - 0, 2, 6 нед) (Абдулхаков С.Р., Абдулхаков Р.А., 2009) (Абдулхаков Р.А., 2003)(Firestein G.S., 2008).
‹‹ Предыдущая Следующая ››
Автор материала: Булгакова Яна Сергеевна, кандидат биологических наук, ООО Сайнсфайлз
Понравилась статья? Поделись с друзьями!
Также стоит почитать:
Загрузка...



























 Важно знать:
Важно знать: Полезно:
Полезно: Интересно:
Интересно:




